
BENEFIX 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como utilizar BENEFIX 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Traduzido com IA
Esta informação é fornecida apenas para fins informativos e não substitui a consulta de um médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Mostrar originalConteúdo do folheto informativo
Introdução
Prospecto: informação para o utilizador
BeneFIX 250UI pó e dissolvente para solução injectável
BeneFIX 500UI pó e dissolvente para solução injectável
BeneFIX 1000UI pó e dissolvente para solução injectável
BeneFIX 1500UI pó e dissolvente para solução injectável
BeneFIX 2000UI pó e dissolvente para solução injectável
BeneFIX 3000UI pó e dissolvente para solução injectável
nonacog alfa (factor IX de coagulação recombinante)
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi-lhe prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é BeneFIX e para que é utilizado
- O que necessita de saber antes de começar a usar BeneFIX
- Como usar BeneFIX
- Posíveis efeitos adversos
- Conservação de BeneFIX
- Conteúdo do envase e informações adicionais
1. O que é BeneFIX e para que é utilizado
BeneFIX é um produto de factor IX de coagulação injectável obtido por tecnologia de ADN recombinante. A substância activa de BeneFIX é nonacog alfa. As pessoas que nascem com hemofilia B (doença de Christmas) não têm suficiente factor IX para controlar as hemorragias. BeneFIX actua repondo o factor IX nos pacientes com hemofilia B para permitir que o seu sangue possa coagular-se.
BeneFIX é utilizado para o tratamento e prevenção de hemorragias em pacientes com hemofilia B (deficiência de factor IX congénita) em todos os grupos etários.
2. O que necessita de saber antes de começar a usar BeneFIX
Não use BeneFIX
- se for alérgico a nonacog alfa ou a algum dos outros componentes deste medicamento (incluídos na secção 6);
- se for alérgico às proteínas de hámster.
Advertências e precauções
- Consulte o seu médico ou farmacêutico antes de começar a usar BeneFIX.
- Consulte o seu médico imediatamente se a sua hemorragia não se detiver como caberia esperar.
- Podem produzir-se reacções alérgicas. O produto pode conter traços de proteínas de hámster (ver Não use BeneFIX). Com produtos de factor IX, incluindo BeneFIX, produziram-se reacções anafilácticas (reacções alérgicas graves) que potencialmente podem pôr em risco a vida. Os sinais iniciais das reacções de alergia incluem dificuldade para respirar, respiração entrecortada, tumefacção ou inchação, habão urticarial, picor, urticária generalizada, opressão no peito, jadeo, pressão arterial baixa, visão borrosa e anafilaxia (reacção alérgica grave que pode causar dificuldade ao engolir e/ou ao respirar, enrubescimento ou inchação da face e/ou das mãos).
- Se se produzir uma reacção de tipo alérgico ou anafiláctico detenha imediatamente a perfusão e contacte com um médico ou procure imediatamente ajuda médica de urgência. Em caso de reacções alérgicas graves, deve considerar-se a utilização de uma terapia alternativa.
- A aparência de anticorpos neutralizantes (inibidores) é um acontecimento pouco frequente em pacientes que receberam tratamento prévio com produtos que contêm factor IX. No entanto, como com todos os produtos que contêm factor IX, deve ser vigilado cuidadosamente por si desenvolve inibidores do factor IX enquanto está em tratamento com BeneFIX.
- Estudos mostraram uma relação entre a aparência de um inibidor do factor IX e reacções alérgicas. Por isso, se experimentar reacções alérgicas como as descritas acima, deverá ser examinado para determinar a presença de um inibidor. Deve ter-se em conta que os pacientes com um inibidor do factor IX podem apresentar um risco aumentado de anafilaxia num futuro tratamento com BeneFIX.
- A produção de factor IX no organismo está controlada pelo gene do factor IX. Os pacientes com mutações específicas do gene do factor IX, como uma deleção importante, podem ter mais probabilidades de desenvolver um inibidor do factor IX e/ou sofrer reacções alérgicas. Por isso, se se sabe que tem essa mutação, o seu médico pode monitorizá-lo mais de perto por si houver sinais de uma reacção alérgica, especialmente quando começar a tomar BeneFIX pela primeira vez.
- Dado o risco de reacções alérgicas com factor IX, as administrações iniciais de BeneFIX devem ser realizadas sob supervisão médica, onde possa ser proporcionado um cuidado médico adequado para as reacções alérgicas.
- Ainda na ausência de inibidor do factor IX, podem ser necessárias doses maiores de BeneFIX do que as que se precisam para outros de factor IX derivados de plasma que tenha recebido anteriormente. Por conseguinte, deve realizar-se uma estreita monitorização da actividade de factor IX no plasma (que mede a capacidade do seu sangue para formar coágulos) com objecto de ajustar a dose adequadamente. Se a hemorragia não se controla com a dose recomendada, contacte o seu médico.
- Se sofre de doença do fígado ou do coração ou se sofreu recentemente uma intervenção cirúrgica, existe um maior risco de complicações de coagulação do sangue.
- Foi comunicada uma alteração dos rins (síndroma nefrótico) após a administração de doses altas de factor IX derivado do plasma em pacientes com hemofilia B com inibidores do factor IX e antecedentes de reacções alérgicas.
- Não foram obtidos dados suficientes dos ensaios clínicos de pacientes não tratados previamente (pacientes que nunca receberam uma perfusão com factor IX) com BeneFIX.
- Recomenda-se que cada vez que use BeneFIX registe o nome e o número do lote do produto. Pode usar uma das etiquetas despegáveis que se encontram no frasco para deixar constância do número do lote no seu diário ou para notificar qualquer reacção adversa.
Outros medicamentos e BeneFIX
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pudesse ter que utilizar qualquer outro medicamento.
Gravidez, lactação e fertilidade
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, apenas deve receber BeneFIX por indicação específica do seu médico. Desconhece-se se BeneFIX pode causar dano ao feto quando é administrado a mulheres grávidas. Se está em período de lactação ou engravidar, o médico pode aconselhá-lo a suspender o tratamento com BeneFIX.
Consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Condução e uso de máquinas
A influência de BeneFIX sobre a capacidade para conduzir e utilizar máquinas é nula.
BeneFIX contém sódio
Após a reconstituição, BeneFIX contém 0,2 mmol de sódio (4,6 mg) por frasco; isto é, essencialmente “isento de sódio”. No entanto, de acordo com o seu peso corporal e a sua dose de BeneFIX, pode receber múltiplos frascos. Isto deve ser tido em conta se segue uma dieta baixa em sal.
3. Como usar BeneFIX
Siga exactamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte de novo o seu médico ou farmacêutico.
O seu médico decidirá a dose de BeneFIX que receberá. Esta dose e a sua duração dependerão das suas necessidades individuais de tratamento substitutivo com factor IX e da rapidez com que o seu organismo utilizar o factor IX, o que será comprovado regularmente. Poderá apreciar uma diferença na dose que recebe se mudar de um produto de factor IX derivado de plasma para BeneFIX.
O seu médico pode modificar a dose de BeneFIX que receber ao longo do tratamento.
Reconstituição e administração
As instruções facilitadas a seguir são uma guia para a reconstituição e administração de BeneFIX. Os pacientes devem seguir as instruções de venopunção específicas indicadas pelo seu médico.
BeneFIX é administrado mediante perfusão intravenosa (IV) após a reconstituição do pó para injeção com o dissolvente incluído na seringa pré-carregada (solução de cloreto de sódio).
Lave sempre as mãos antes de realizar os procedimentos seguintes. Durante o procedimento de reconstituição, deve seguir-se uma técnica asséptica (que significa limpo e livre de germes).
Reconstituição:
BeneFIX será administrado por perfusão intravenosa (IV) após a reconstituição com dissolvente estéril para injeção.
- Permita que o frasco liofilizado de BeneFIX e a seringa pré-carregada de dissolvente atinjam a temperatura ambiente.
- Retire a cápsula de fecho do frasco de BeneFIX para que fique visível a parte central do tampão de borracha.
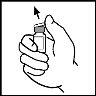
- Limpe a parte superior do frasco com a torunda embebida em álcool que se fornece ou utilize outra solução antiséptica e espere até que seque. Depois de limpar, não toque no tampão de borracha com a sua mão e evite que toque qualquer superfície.
- Retire a tampa protectora do invólucro de plástico transparente do adaptador. Não retire o adaptador do invólucro.
- Coloque o frasco sobre uma superfície plana. Enquanto segura o adaptador no seu invólucro, coloque-o sobre o frasco. Pressione-o firmemente até que o adaptador encaixe no alto do frasco, com a ponta do adaptador a penetrar no tampão do frasco.
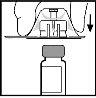
- Retire o invólucro do adaptador e desfaça-se dele.
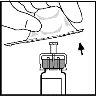
- Encaixe a barra do êmbolo na seringa do dissolvente empurrando-a e girando-a firmemente.
- Parta a tampa de plástico resistente à manipulação partindo a perfuração do capuz. Isto é feito dobrando o capuz para cima e para baixo até que se parta a perfuração. Não toque no interior do capuz nem na ponta da seringa. O capuz pode precisar de ser substituído (se BeneFIX reconstituído não for administrado imediatamente), por isso desfaça-se dele colocando-o na parte superior.
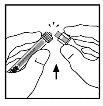
- Coloque o frasco sobre uma superfície plana. Conecte a seringa do dissolvente ao adaptador do frasco inserindo a ponta da seringa na abertura do adaptador enquanto empurra e gira firmemente a seringa no sentido dos ponteiros do relógio até que encaixe perfeitamente.
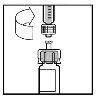
- Faça descer lentamente o êmbolo para injetar todo o dissolvente no frasco de BeneFIX.
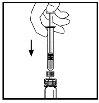
- Com a seringa ainda conectada ao adaptador, gire suavemente o frasco até que se dissolva o pó.
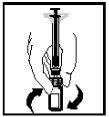
- A solução final deve ser examinada visualmente em busca de partículas finas antes da administração. A solução deve aparecer transparente e incolor.
Nota: Se utilizar mais de um frasco de BeneFIX para perfusão, cada frasco deve ser reconstituído de acordo com as instruções acima. A seringa de dissolvente deve ser desfeita, deixando o adaptador do frasco no seu lugar e, em seguida, utilizar-se-á uma seringa grande do tipo Luer Lock (um dispositivo que conecta a seringa ao frasco) para retirar o conteúdo reconstituído de cada frasco individual.
- Gire o frasco assegurando-se de que o êmbolo da seringa desceu por completo. Aspire lentamente toda a solução para o interior da seringa.
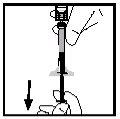
- Liberte a seringa do adaptador empurrando e girando lentamente a seringa no sentido dos ponteiros do relógio. Desfaça-se do frasco unido ao adaptador.
Nota: Se a solução não for utilizada imediatamente, o capuz deve ser substituído cuidadosamente. Não toque na ponta da seringa nem no interior do capuz.
BeneFIX deve ser administrado imediatamente após a sua reconstituição, ou bem dentro das 3 horas seguintes. A solução reconstituída pode ser armazenada à temperatura ambiente antes da administração.
Administração (Injeção intravenosa):
BeneFIX deve ser administrado mediante a seringa pré-carregada de dissolvente que se fornece ou mediante uma seringa de plástico descartável estéril do tipo Luer Lock. Além disso, a solução deve ser extraída do frasco utilizando o adaptador do frasco.
BeneFIX deve ser injetado intravenosamente durante vários minutos. O médico pode alterar a velocidade da perfusão recomendada para que lhe resulte mais cómoda.
Foram notificados casos de aglutinação de hematíes no tubo ou na seringa durante a administração de BeneFIX. Não foram comunicados efeitos adversos em relação a esta observação. Para reduzir ao mínimo a possibilidade de aglutinação, é importante limitar a quantidade de sangue que entra no tubo. O sangue não deve entrar na seringa. Se se observar aglutinação de hematíes no tubo ou na seringa, desfaça-se de todo o material (tubo, seringa e solução de BeneFIX) e reinicie a administração com um novo frasco.
Como o uso de BeneFIX em perfusão contínua (gota a gota) não foi avaliado, BeneFIX não deve ser misturado com soluções para perfusão ou administrado gota a gota.
Desfaça-se da solução não utilizada, dos frascos vazios e das agulhas e seringas utilizadas num recipiente adequado para eliminar resíduos que possam provocar lesões, se não forem manuseados adequadamente.
Se usar mais BeneFIX do que deve
Se injetar uma quantidade de BeneFIX superior à recomendada pelo médico, contacte-o imediatamente.
Se interromper o tratamento com BeneFIX
Não interrompa o tratamento com BeneFIX sem consultar o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
4. Efeitos adversos possíveis
Tal como todos os medicamentos, este medicamento pode causar efeitos adversos, embora nem todas as pessoas os sofram.
Reações de hipersensibilidade/alergia
É possível que ocorram reações de hipersensibilidade de tipo alérgico com BeneFIX. Tais reações podem consistir em inchaço do rosto ou da garganta, coceira e picada no local de perfusão, arrepios, rubor (vermelhidão da pele), prurido, dor de cabeça, urticária, diminuição da pressão arterial, letargia, náuseas, inquietude, aumento da frequência cardíaca, opressão no peito, formigamento, vômitos, sibilância (ruídos ao respirar). Em alguns casos, estas reações progrediram até se tornarem anafilaxias graves. Pode ocorrer reações alérgicas juntamente com o desenvolvimento de inibidores do fator IX (ver também “Advertências e precauções”).
Estas reações podem potencialmente colocar em risco a vida. Se ocorrerem reações anafilácticas/alérgicas, interrompa imediatamente a perfusão e contate um médico ou procure imediatamente ajuda médica de emergência. O tratamento necessário dependerá da natureza e gravidade dos efeitos adversos (ver também “Advertências e precauções”).
Desenvolvimento de inibidores
Os pacientes com hemofilia B podem desenvolver anticorpos neutralizantes (inibidores) ao fator IX. Se isso ocorrer, um sinal pode ser um aumento na quantidade de BeneFIX que normalmente é necessária para tratar uma hemorragia, e/ou que a hemorragia continue após o tratamento. Nesses casos, é recomendável contatar um centro especializado em hemofilia. Seu médico pode monitorá-lo para controlar o desenvolvimento de inibidores (ver “Advertências e precauções”).
Foi relatada uma alteração nos rins após a administração de doses altas de fator IX derivado do plasma para a indução de imunotolerância em pacientes com hemofilia B com inibidores de fator IX e antecedentes de reações alérgicas (ver também “Advertências e precauções”).
Eventos trombóticos
BeneFIX pode aumentar o risco de trombose (coágulos de sangue anormais) no seu organismo, se você tiver fatores de risco para o desenvolvimento de coágulos de sangue, incluindo um cateter venoso permanente. Foram relatados casos graves de coágulos de sangue, incluindo coágulos de sangue com risco para a vida em bebês criticamente doentes, enquanto recebiam BeneFIX em perfusão contínua através de um cateter venoso central. Também foram relatados casos de tromboflebite periférica (dor e vermelhidão das veias) e trombose venosa profunda (coágulos de sangue nas extremidades); na maioria desses casos, BeneFIX havia sido administrado por meio de perfusão contínua, que é um método de administração não aprovado.
Efeitos adversos muito frequentes(podem afetar mais de 1 de cada 10 pessoas)
- Dor de cabeça
- Tosse
- Febre
Efeitos adversos frequentes(podem afetar até 1 de cada 10 pessoas)
- Reações de hipersensibilidade ou alergia
- Tontura, alteração do sentido do gosto
- Flebite (dor e vermelhidão das veias), rubor (vermelhidão da pele)
- Vômitos, náuseas
- Erupção cutânea, urticária
- Desconforto no peito (incluindo dor no peito)
- Reação no local de perfusão (incluindo coceira e vermelhidão no local de perfusão), dor e desconforto no local de perfusão
Efeitos adversos pouco frequentes(podem afetar até 1 de cada 100 pessoas)
- Aparição de anticorpos neutralizantes (inibidores)
- Celulite no local de perfusão (dor e vermelhidão da pele)
- Sonolência, tremores
- Alteração da visão (incluindo visão borrada, aparição de manchas ou luzes)
- Aumento da frequência cardíaca, diminuição da pressão arterial
- Infarto renal (interrupção do suprimento sanguíneo ao rim)
Efeitos adversos de frequência desconhecida(não pode ser estimada a partir dos dados disponíveis)
- Reação anafilática
- Eventos trombóticos (coágulos de sangue anormais)
- Ausência de resposta ao tratamento (os episódios de sangramento não podem ser detidos ou evitados)
Comunicação de efeitos adversos
Se você experimentar qualquer tipo de efeito adverso, consulte seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Você também pode relatá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Ao relatar efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de BeneFIX
Mantenha este medicamento fora da vista e do alcance das crianças.
Não use este medicamento após a data de validade que aparece no estojo e na etiqueta do frasco. A data de validade é o último dia do mês que é indicado.
BeneFIX deve ser conservado a uma temperatura abaixo de 30°C e deve ser usado antes da data de validade que aparece na etiqueta.
Não congele o produto para evitar que a seringa precarregada seja danificada.
O produto reconstituído deve ser usado imediatamente ou dentro de 3 horas.
Não use este medicamento se você observar que a solução não é transparente ou incolor.
Para a reconstituição, somente deve ser usada a seringa precarregada que é incluída no estojo. Para a administração, podem ser usadas outras seringas descartáveis estéreis.
Os medicamentos não devem ser jogados nos esgotos ou na lixeira. Pergunte ao seu farmacêutico como se livrar dos recipientes e dos medicamentos que você não precisa mais. Dessa forma, você ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e informações adicionais
Composição de BeneFIX
- O princípio ativo é nonacog alfa (fator IX de coagulação recombinante). Cada frasco de BeneFIX contém nominalmente 250, 500, 1000, 1500, 2000 ou 3000 UI de nonacog alfa.
- Os demais componentes são sacarose, glicina, L-histidina, polissorbato 80. É incluído um diluente para a reconstituição (solução de cloreto de sódio a 0,234%).
- Após a reconstituição com o diluente incluído, (solução de cloreto de sódio a 0,234%) cada frasco contém 50, 100, 200, 300, 400 ou 600 UI, respectivamente (ver tabela 1), de nonacog alfa por 1 ml da solução para injeção preparada.
Tabela 1. Concentração de BeneFIX por ml de solução preparada
Quantidade de BeneFIX por frasco | Quantidade de BeneFIX por 1 ml de solução preparada para injeção |
250 UI | 50 UI |
500 UI | 100 UI |
1000 UI | 200 UI |
1500 UI | 300 UI |
2000 UI | 400 UI |
3000 UI | 600 UI |
Aspecto do produto e conteúdo do pacote
BeneFIX é fornecido como um pó para injeção em um frasco de vidro e um diluente fornecido em uma seringa precarregada.
O pacote contém:
- um frasco com BeneFIX 250, 500, 1000, 1500, 2000 ou 3000 UI pó
- uma seringa precarregada com diluente, 5 ml de solução de cloreto de sódio a 0,234% para a reconstituição
- um adaptador estéril para a reconstituição
- um sistema de perfusão estéril
- duas torundas com álcool
- um curativo adesivo
- uma compressa de gaze
Título da autorização de comercialização
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelas
Bélgica
Responsável pela fabricação
Wyeth Farma S.A
Autovía del Norte.A-1, Km. 23. Desvío Algete, Km. 1, 28700 San Sebastián de los Reyes, Madrid
Espanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização.
Bélgica/Bélgica/Bélgica Luxemburgo/Luxemburgo Pfizer NV/SA Tel/Tel: +32 (0)2 554 62 11 | Lituânia Pfizer Luxembourg SARL filial na Lituânia Tel: +3705 2514000 |
Bulgária Pfizer Bulgaria EOOD Tel: +359 2 970 4333 | Hungria Pfizer Kft. Tel.: + 36 1 488 37 00 |
República Tcheca Pfizer, spol. s r.o. Tel: +420 283 004 111 | Malta Vivian Corporation Ltd. Tel: +356 21344610 |
Dinamarca Pfizer ApS Tlf.: +45 44 20 11 00 | Países Baixos Pfizer bv Tel: +31 (0)800 63 34 636 |
Alemanha PFIZER PHARMA GmbH Tel: +49 (0)30 550055-51000 | Noruega Pfizer AS Tlf: +47 67 52 61 00 |
Estônia Pfizer Luxembourg SARL filial na Estônia Tel: +372 666 7500 | Áustria Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
Grécia Pfizer Ελλάς Α.Ε. Τηλ: +30 210 6785800 | Polônia Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
Espanha Pfizer, S.L. Tel: +34 91 490 99 00 | Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
França Pfizer Tél: +33 (0)1 58 07 34 40 | Romênia Pfizer Romênia S.R.L. Tel: +40 21 207 28 00 |
Croácia Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 | Eslovênia Pfizer Luxembourg SARL Pfizer, filial para consultoria em atividades farmacêuticas, Liubliana Tel: + 386 (0)1 52 11 400 |
Irlanda Pfizer Healthcare Ireland Unlimited Company Tel: 1800 633 363 (gratuito) Tel: +44 (0)1304 616161 | Eslováquia Pfizer Luxembourg SARL, filial Tel: + 421 2 3355 5500 |
Islândia Icepharma hf. Sími: + 354 540 8000 | Finlândia Pfizer Oy Puh/Tel: +358 (0)9 430 040 |
Itália Pfizer S.r.l. Tel: +39 06 33 18 21 | Suécia Pfizer AB Tel: +46 (0)8 550 520 00 |
Chipre Pfizer Ελλάς Α.Ε. (filial no Chipre) Τηλ: +357 22817690 | |
Letônia Pfizer Luxembourg SARL filial na Letônia Tel: +371 670 35 775 | |
Data da última revisão deste prospecto: 03/2025.
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu. Também existem links para outros sites sobre doenças raras e medicamentos órfãos.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para fins informativos e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento.
- Alternativas a BENEFIX 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 2.000 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médicaForma farmacêutica: INJETÁVEL, 250 UISubstância ativa: coagulation factor IXFabricante: Swedish Orphan Biovitrum Ab (Publ)Requer receita médica
Médicos online para BENEFIX 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de dosagem, efeitos secundários, interações, contraindicações e renovação de receita para BENEFIX 1000 UI, PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL — sujeita a avaliação médica e à regulamentação local.
Perguntas frequentes

Receba atualizações e ofertas exclusivas
Seja o primeiro a conhecer novos serviços, atualizações do marketplace e ofertas exclusivas para subscritores.














