
COFACT 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL

Como utilizar COFACT 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Traduzido com IA
Esta informação é fornecida apenas para fins informativos e não substitui a consulta de um médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Mostrar originalConteúdo do folheto informativo
Introdução
Prospecto: informação para o utilizador
Cofact 250UI pó e dissolvente para solução injetável.
Complexo de protrombina humana
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que o reler.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Cofact e para que é utilizado
- O que precisa saber antes de começar a usar Cofact
- Como usar Cofact
- Possíveis efeitos adversos
- Conservação de Cofact
- Conteúdo do envase e informações adicionais
1. O que é Cofact e para que é utilizado
Cofact contém como princípios ativos, os factores II, VII, IX e X, que são factores de coagulação do sangue humano.
Estes factores são componentes naturais do sangue humano, e são comumente chamados de complexo de protrombina. São dependentes da vitamina K. Se houver uma deficiência de um ou mais destes factores, podem ocorrer distúrbios da coagulação sanguínea. Como resultado disto, há uma maior tendência ao sangramento. A administração de Cofact ajuda a complementar esta deficiência, combatendo ou prevenindo hemorragias.
Cofact pode ser utilizado para:
O tratamento ou prevenção de sangramentos, devidos a
- deficiência adquirida dos factores de coagulação do complexo de protrombina. Por exemplo, em caso de deficiência causada pelo tratamento com antagonistas da vitamina K ou em caso de sobredose de antagonistas da vitamina K, quando se requer uma rápida correção desta deficiência.
- deficiências congénitas de um dos factores de coagulação dependentes da vitamina K, quando não se dispõe de produtos purificados do factor de coagulação específico.
2. O que precisa saber antes de começar a usar Cofact
Não use Cofact
- se é alérgico (hipersensível) a algum dos princípios ativos ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico especializado em distúrbios da coagulação antes de receber este medicamento.
- Se tem uma deficiência adquirida dos factores de coagulação dependentes da vitamina K (por exemplo, causada pelo tratamento com medicamentos antagonistas da vitamina K), Cofact só deve ser utilizado quando é necessária uma rápida correção dos níveis do complexo de protrombina, como no caso de um sangramento grave ou uma intervenção cirúrgica de urgência. Noutros casos, geralmente é suficiente a redução da dose do medicamento antagonista da vitamina K e/ou a administração de vitamina K.
- Se recebe um medicamento antagonista da vitamina K pode apresentar um maior risco de formação de coágulos. Neste caso, o tratamento com Cofact pode potenciar este risco.
- Se nasceu com uma deficiência de algum dos factores de coagulação dependentes da vitamina K (deficiência congénita), devem ser utilizados produtos específicos para o factor de coagulação quando estiverem disponíveis.
- Se ocorre uma reação alérgica ou de tipo anafiláctico, deve interromper-se a perfusão com Cofact imediatamente.
Existe um risco de trombose ou coagulação intravascular disseminada (ou seja, formação de coágulos de sangue nos vasos sanguíneos) quando se recebe este medicamento, especialmente quando se recebe repetidamente.
- O seu médico comprovará se a administração deste medicamento representa um risco de trombose (ver secção 4). As seguintes pessoas têm uma maior probabilidade de sofrer uma trombose:
- pessoas que sofreram um infarto do miocárdio ou que tiveram (ou ainda têm) outras doenças das artérias do coração
- pessoas com doenças do fígado
- recém-nascidos (neonatos)
- pessoas que se vão submeter em breve a uma operação ou que se operaram recentemente
- pessoas com maior probabilidade de sofrer complicações de coagulação (por exemplo, antecedentes de acontecimentos tromboembólicos ou coagulação intravascular disseminada)
O seu médico considerará cuidadosamente o benefício do tratamento com este medicamento em comparação com o risco destas complicações.
Segurança viral
Quando os medicamentos são preparados a partir de sangue ou plasma humanos, são adoptadas certas medidas para prevenir a transmissão de infecções aos pacientes. Estas medidas incluem:
- uma cuidadosa seleção dos doadores de sangue e plasma para assegurar que se exclua as pessoas com risco de ser portadoras de infecções,
- a análise de cada doação e das misturas de plasma para detectar a presença de sinais de vírus/infecções,
- a inclusão de etapas no processamento de sangue ou plasma que podem inactivar ou eliminar os vírus.
Apesar destas medidas, quando se administram medicamentos preparados a partir de sangue ou plasma humanos, não se pode excluir totalmente a possibilidade de transmissão de infecções. Isto também se refere a qualquer vírus emergente ou de natureza desconhecida e a outros tipos de infecções.
As medidas adoptadas são consideradas eficazes para vírus envoltos como o vírus da imunodeficiência humana (VIH), o vírus da hepatite B (VHB) e o vírus da hepatite C (VHC) e para o vírus não envolto da hepatite A (VHA). As medidas adoptadas podem ter um valor limitado contra outros vírus não envoltos como o parvovirus B19. A infecção por parvovirus B19 pode ser grave em mulheres grávidas (infecção do feto) e em pessoas cujo sistema imunitário está deprimido ou que têm algum tipo de anemia (p. ex., doença drepanocítica ou anemia hemolítica).
Recomenda-se encarecidamente que cada vez que se lhe administre uma dose deste medicamento, se registe o nome e número de lote do produto, com o fim de ter um historial dos lotes utilizados.
Crianças e adolescentes
Não se dispõe de dados em relação ao uso deste medicamento em crianças ou adolescentes.
Outros medicamentos e Cofact
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento, mesmo os adquiridos sem receita médica.
Não se dispõe de informação relativa às possíveis interacções entre Cofact e outros medicamentos, à excepção dos anticoagulantes.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento. Se está grávida ou em período de amamentação, o seu médico lhe administrará Cofact apenas se estiver claramente indicado.
Condução e uso de máquinas
Não se realizaram estudos sobre os efeitos na capacidade de conduzir ou usar máquinas.
Cofact contém sódio
Cofact contém até 448 mg de sódio (componente principal do sal de mesa ou para cozinhar) por 100 ml. Isto equivale a até 22% da ingestão diária máxima recomendada de sódio para um adulto. Tenha isto em conta se segue uma dieta controlada de sódio.
3. Como usar Cofact
O seu tratamento deve ser iniciado, administrado e monitorizado por um médico com experiência no tratamento dos distúrbios da coagulação. O seu médico determinará a quantidade de Cofact que precisa para o tratamento ou prevenção de hemorragias devidas ao uso de anticoagulantes ou em caso de deficiência congénita de um dos factores de coagulação dependentes da vitamina K.
A dose exacta depende de:
- a gravidade da sua doença
- o seu peso
- os factores de coagulação que precisa
- a quantidade destes factores no seu sangue (o seu nível no sangue).
Em caso de deficiência congénita dos factores de coagulação, é importante determinar periodicamente os níveis no sangue dos factores de coagulação.
A informação para profissionais de saúde encontra-se no final do prospecto.
Se usa mais Cofact do que deve
O seu médico deve comprovar regularmente o estado dos coágulos durante o tratamento. As doses elevadas de concentrado de complexo de protrombina associaram-se a casos de infarto do miocárdio, coagulação intravascular disseminada e um aumento da formação de coágulos num vaso sanguíneo em pacientes com risco de sofrer estas complicações.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Foram observados os seguintes efeitos adversos:
Frequentes(pode afectar menos de 1 em cada 10 pessoas):
- existe um risco de formação de coágulos sanguíneos (ver secção 2)
Pouco frequentes(pode afectar menos de 1 em cada 100 pessoas):
- existe um risco de descida da pressão arterial
A frequência dos seguintes efeitos secundários é desconhecida(a frequência não pode ser estimada a partir dos dados disponíveis):
- Reacções de hipersensibilidade ou alérgicas (ver secção 2)
- Ataque ao coração
- Náuseas, vómitos
- Verduração na localização de uma perfusão, irritação na localização de uma perfusão, inchação na localização de uma perfusão, malestar
- Aumento temporário dos resultados dos testes hepáticos
- Acidente vascular cerebral, tonturas
- Embolia pulmonar, dificuldade para respirar
- Sudorese excessiva, picazão na pele, urticária, erupção cutânea
Os pacientes com deficiência de um dos factores de coagulação II, VII, IX ou X podem desenvolver anticorpos contra estes factores como resultado de usar Cofact. Nesse caso, a actividade do produto não será óptima.
Comunicação de efeitos adversos
Se experimenta qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRAM.es. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de Cofact
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e na etiqueta do frasco após CAD. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (2 °C – 8 °C). Não congelar. Conservar o frasco no embalagem exterior para protegê-lo da luz.
Cofact pode ser conservado a ou abaixo de 25 °C durante seis meses. A data em que o medicamento atingiu a temperatura ambiente deve ser anotada no envase. Se não for utilizado durante os seis meses conservado a temperatura ambiente, o produto deve ser deitado fora.
Uma vez que o produto é retirado do frigorífico, não deve ser devolvido a ele.
Demonstrou-se a estabilidade do produto dissolvido até 3 horas a 15 °C - 25 °C. No entanto, para prevenir a contaminação, o produto dissolvido deve ser utilizado imediatamente.
Os medicamentos não devem ser deitados fora pelo esgoto ou para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informações adicionais
Composição de Cofact
- Os princípios ativos são os factores de coagulação II, VII, IX e X e outros princípios ativos são as proteínas C e proteína S.
- Um frasco de Cofact 250 UI contém 250 UI de factor IX; 140-350 UI de factor II; 70-200 UI de factor VII e 140-350 UI de factor X; 111-390 UI de proteína C; 10-80 UI de proteína S.
Após dissolver em água para preparações injetáveis que se fornece, a solução para injetar pronta para uso contém:
- Não menos de 14 UI e não mais de 35 UI de factor II por ml;
- Não menos de 7 UI e não mais de 20 UI de factor VII por ml;
- 25 UI de factor IX por ml;
- Não menos de 14 UI e não mais de 35 UI de factor X por ml;
- Não menos de 11 UI e não mais de 39 UI de proteína C por ml;
- Não menos de 1 UI e não mais de 8 UI de proteína S por ml.
Os outros componentes são citrato de sódio, cloreto de sódio e antitrombina.
Aspecto do produto e conteúdo do envase
Cofact é fornecido como pó e dissolvente para uma solução injetável.
Cofact pó para injetar é um pó de cor azulada. O dissolvente é um líquido claro, incolor e sem partículas visíveis. A solução preparada e pronta para a injeção é uma solução de cor azulada.
Conteúdo do envase de 250UI
1 frasco de pó de 250 UI
1 frasco de 10 ml de água para preparações injetáveis
1 agulha de transferência
Pode ser que apenas alguns tamanhos de envases sejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Prothya Biosolutions Netherlands B.V.
Plesmanlaan 125
NL-1066 CX Amesterdão
Países Baixos
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Áustria, Bélgica, Finlândia, França, Alemanha, Islândia, Itália, Luxemburgo, Países Baixos e Espanha: Cofact.
Suécia: Thyaplex.
Data da última revisão deste prospecto: Agosto 2024
--------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do sector sanitário:
Composição qualitativa e quantitativa
Cofact apresenta-se sob a forma de pó e diluente para solução injetável que contém o complexo de protrombina humana. O produto contém nominalmente as seguintes UI dos factores de coagulação humanos:
Cofact 250 UI | Após a reconstituição*(UI/ml) | ||
Princípios ativos | |||
Fator II de coagulação | 140 – 350 | 14 – 35 | |
Fator VII de coagulação | 70 – 200 | 7 – 20 | |
Fator IX de coagulação | 250 | 25 | |
Fator X de coagulação | 140 – 350 | 14 – 35 | |
Outros princípios ativos | |||
Proteína C | 111 – 390 | 11 – 39 | |
Proteína S | 10 – 80 | 1 – 8 | |
*Após a reconstituição com 10 ml de água para preparações injetáveis.
O conteúdo total de proteínas por frasco de 250 UI é 130 – 350 mg. A atividade específica do produto é ≥ 0,6 UI/mg, expressa como atividade do fator IX.
A atividade de todos os factores de coagulação, bem como das proteínas C e S (antígenos) foi determinada de acordo com os padrões atuais da OMS ou da Farmacopeia Europeia.
Após a reconstituição, este medicamento contém 125 – 195 mmol de sódio/l, até 44,8 mg de sódio por frasco de 250 UI.
Posologia e forma de administração
Posologia
A seguir são fornecidas apenas diretrizes gerais de dosagem. O tratamento deve ser iniciado sob a supervisão de um médico com experiência no tratamento de distúrbios de coagulação. A dose e duração do tratamento de substituição dependem da gravidade do distúrbio, da localização e intensidade do sangramento e do quadro clínico do paciente.
A posologia e frequência de administração devem ser calculadas de forma individual para cada paciente. Os intervalos de dosagem devem ser adaptados às diferentes meias-vidas circulantes dos diferentes factores de coagulação no complexo de protrombina. Os requisitos posológicos individuais só podem ser calculados com base na determinação periódica dos níveis plasmáticos individuais dos factores de coagulação em questão, ou da análise global dos níveis do complexo de protrombina (tempo de protrombina, INR) e na monitorização contínua da situação clínica do paciente.
No caso de intervenções cirúrgicas maiores, é imprescindível uma monitorização precisa do tratamento de substituição, por meio de análises de coagulação (avaliações do fator de coagulação específico e/ou análises globais dos níveis de complexo de protrombina).
Sangramento e profilaxia perioperatória de sangramentos durante o tratamento com antagonistas da vitamina K:
A dose dependerá do INR antes do tratamento, do INR desejado e do peso corporal. Nas seguintes tabelas são fornecidas doses aproximadas que são necessárias para a normalização do INR a diferentes níveis iniciais de INR.
As tabelas de dose só representam as diretrizes gerais de dosagem, o que não pode substituir a avaliação individual da dose para cada paciente e o controle rigoroso do INR e outros parâmetros de coagulação durante o tratamento.
Doses recomendadas de Cofact em ml para alcançar um INR desejado ≤ 2,1
INR inicial Peso corporal | 7,5 | 5,9 | 4,8 | 4,2 | 3,6 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,3 | 2,2 |
50kg | 40 | 40 | 40 | 30 | 30 | 30 | 20 | 20 | X | X | X | X |
60kg | 50 | 50 | 40 | 40 | 30 | 30 | 30 | 20 | X | X | X | X |
70kg | 60 | 50 | 50 | 50 | 40 | 40 | 30 | 30 | X | X | X | X |
80kg | 60 | 60 | 60 | 50 | 50 | 40 | 40 | 30 | X | X | X | X |
90kg | 60 | 60 | 60 | 60 | 50 | 50 | 40 | 30 | X | X | X | X |
100kg | 60 | 60 | 60 | 60 | 60 | 50 | 40 | 40 | X | X | X | X |
Doses recomendadas de Cofact em ml para alcançar um INR desejado ≤ 1,5
INR inicial Peso corporal | 7,5 | 5,9 | 4,8 | 4,2 | 3,6 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,3 | 2,2 |
50kg | 60 | 60 | 60 | 50 | 50 | 50 | 40 | 40 | 30 | 30 | 30 | 30 |
60kg | 80 | 70 | 70 | 60 | 60 | 60 | 50 | 50 | 40 | 40 | 40 | 30 |
70kg | 90 | 80 | 80 | 70 | 70 | 70 | 60 | 60 | 50 | 40 | 40 | 40 |
80kg | 100 | 100 | 90 | 90 | 90 | 80 | 80 | 70 | 60 | 50 | 50 | 40 |
90kg | 100 | 100 | 100 | 90 | 90 | 90 | 80 | 80 | 70 | 60 | 50 | 40 |
100kg | 100 | 100 | 100 | 100 | 100 | 90 | 90 | 80 | 70 | 70 | 60 | 50 |
As doses são calculadas com base na concentração de fator IX em Cofact, devido à sua meia-vida relativamente curta e baixo rendimento após a perfusão em comparação com os outros factores de coagulação em Cofact. Pressupõe-se que uma concentração plasmática média de fator IX ≥ 30% é suficiente para alcançar um INR ≥ 2,1 e ≥ 60% para alcançar um INR ≥ 1,5. As quantidades calculadas são arredondadas em múltiplos de 10 ml e estabeleceu-se um limite superior de 60 ou 100 ml no total (ver as tabelas acima). Os valores de INR desejados são recomendados pela Federação de Serviços Holandeses de Trombose e são do mesmo nível que as recomendações Inglesas e Alemãs.
A correção do distúrbio de hemostasia induzido pelos antagonistas da vitamina K persiste durante cerca de 6-8 horas. No entanto, os efeitos da vitamina K, se administrada ao mesmo tempo, normalmente são alcançados em um período de 4-6 horas. Portanto, normalmente não é necessário repetir o tratamento com complexo de protrombina humana quando se administra vitamina K.
Devido a que essas recomendações são empíricas e que a recuperação e a duração do efeito podem variar, é obrigatória a monitorização do INR durante o tratamento.
Sangramento e profilaxia perioperatória da deficiência congênita de qualquer um dos factores de coagulação dependentes da vitamina K, quando não se dispõe do produto de fator de coagulação específico:
O cálculo da dose necessária para o tratamento baseia-se no dado empírico de que aproximadamente 1 UI de fator VII ou de fator IX por kg de peso corporal aumenta a atividade plasmática do fator VII ou IX, respectivamente, em 0,01 UI/ml; e 1 UI de fator II ou X por kg de peso corporal aumenta a atividade plasmática do fator II ou X em 0,02 e 0,017 UI/ml, respectivamente.
A dose de um fator específico administrado é expressa em Unidades Internacionais (UI), que estão relacionadas com o padrão atual da OMS para cada fator. A atividade plasmática de um fator de coagulação específico é expressa, ou bem como um percentual (relativo ao plasma normal) ou em Unidades Internacionais (relativas ao padrão internacional para o fator de coagulação específico).
Uma Unidade Internacional (UI) de atividade de um fator de coagulação é equivalente à quantidade contida em um ml de plasma humano normal.
Por exemplo, o cálculo da dose necessária de fator X baseia-se no dado empírico de que 1 Unidade Internacional (UI) de fator X por kg de peso corporal aumenta a atividade plasmática do fator X em 0,017 UI/ml. A dose necessária é determinada utilizando a seguinte fórmula:
Unidades necessárias = peso corporal (kg) x incremento desejado do fator X (UI/ml) x 60
Onde 60 (ml/kg) é o valor recíproco da recuperação estimada.
Se a recuperação individual for conhecida, este valor deve ser usado para o cálculo.
População pediátrica
Não foi estabelecida a segurança e eficácia do uso de Cofact em pacientes pediátricos.
Forma de administração
Para consultar as instruções de reconstituição do medicamento antes da administração, ver seção 6.6. “Precauções especiais de eliminação e outras manipulações”. Cofact deve ser administrado por via intravenosa.
Recomenda-se administrar o produto reconstituído a uma velocidade de aproximadamente 2 ml por minuto.
Incompatibilidades
Este medicamento não deve ser misturado com outros medicamentos.
Cofact é compatível com material de polipropileno. O tratamento pode falhar devido à adsorção do fator de coagulação na superfície interna de outros equipamentos de injeção/perfusão.
Período de validade
3 anos.
Após a reconstituição, demonstrou-se a estabilidade fisicoquímica em uso durante 3 horas a 15 °C – 25 °C. Do ponto de vista microbiológico, o produto deve ser utilizado imediatamente após a reconstituição. Se não for utilizado imediatamente, os tempos de conservação em uso e as condições antes do uso são responsabilidade do usuário.
Precauções especiais de eliminação e outras manipulações
Dissolução
A fração de proteína seca deve ser dissolvida no volume prescrito de água para preparações injetáveis. Se conservados a 2 °C - 8 °C, é necessário deixar que os frascos de Cofact e a água para injeção alcancem a temperatura ambiente (15 °C – 25 °C) antes de dissolver a preparação.
Procedimento utilizando uma agulha de transferência
- Retire o capuchão protetor de plástico do frasco que contém a água para injeção e do frasco que contém o produto.
- Desinfete os tampões de borracha de ambos os frascos com uma gaze impregnada em álcool (70%).
- Retire o capuchão protetor de um dos extremos da agulha de transferência e insira a agulha no frasco que contém a água para preparações injetáveis (A).
- Em seguida, retire o capuchão protetor do outro extremo da agulha de transferência, vire o frasco que contém a agulha de transferência de cabeça para baixo e introduza imediatamente a agulha que ainda está livre no frasco que contém o produto (B).
A pressão negativa no frasco que contém o produto fará com que a água para preparações injetáveis seja aspirada no frasco. Recomendação: enquanto a água para preparações injetáveis estiver fluindo, o frasco que contém o produto deve ser mantido inclinado e deixar que a água flua ao longo da parede do frasco. Isso ajuda a que o produto se dissolva mais rapidamente. Assim que toda a água tiver fluído, o frasco vazio e a agulha de transferência devem ser retirados em um único gesto.
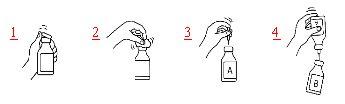
Para acelerar o processo de dissolução, o frasco pode ser girado suavemente e, se necessário, aquecido a 30 °C. O frasco nunca deve ser agitado nem se deve permitir que a temperatura exceda os 37 °C. Se o frasco for aquecido em banho-maria, deve-se ter cuidado para que a água não entre em contato com o capuchão protetor e/ou o tampão de borracha.
Como regra, a substância seca deve ser dissolvida completamente em um prazo de 10 minutos para formar uma solução de cor azul; a cor azul é produzida devido à presença da proteína plasmática ceruloplasmina.
A solução deve ser transparente ou ligeiramente opalescente. Não use soluções que estejam turvas ou que tenham depósitos. O produto reconstituído deve ser inspecionado visualmente para verificar que não contém partículas nem apresenta decoloração antes da administração.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para fins informativos e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento.
- Alternativas a COFACT 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 1000 UI/frascoSubstância ativa: coagulation factor IX, II, VII and X in combinationFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 500 UISubstância ativa: coagulation factor IX, II, VII and X in combinationFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 500 UISubstância ativa: coagulation factor IX, II, VII and X in combinationFabricante: Prothya Biosolutions Netherlands B.V.Requer receita médica
Médicos online para COFACT 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de dosagem, efeitos secundários, interações, contraindicações e renovação de receita para COFACT 250 UI PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL — sujeita a avaliação médica e à regulamentação local.
Perguntas frequentes

Receba atualizações e ofertas exclusivas
Seja o primeiro a conhecer novos serviços, atualizações do marketplace e ofertas exclusivas para subscritores.














