FIRMAGON 120 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL


Como utilizar FIRMAGON 120 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Traduzido com IA
Esta informação é fornecida apenas para fins informativos e não substitui a consulta de um médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Mostrar originalConteúdo do folheto informativo
Introdução
Prospecto: informação para o utilizador
FIRMAGON 120mgpó e dissolvente para solução injetável
degarelix
Leia todo o prospecto detenidamente antes de começar a usar o medicamento,porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Se experimentar efeitos adversos, consulte o seu médico, ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto:
- O que é FIRMAGON e para que é utilizado
- O que necessita saber antes de começar a usar FIRMAGON
- Como usar FIRMAGON
- Possíveis efeitos adversos
- Conservação de FIRMAGON
- Conteúdo do envase e informação adicional
1. O que é FIRMAGON e para que é utilizado
FIRMAGON contém degarelix.
Degarelix é um bloqueador hormonal sintético que é utilizado para o tratamento do cancro e para o tratamento do cancro da próstata de alto risco antes de radioterapia e em combinação com radioterapia em doentes varões adultos. Degarelix simula os efeitos de uma hormona natural (que é a hormona liberadora de gonadotropinas, GnRH), por bloqueio direto dos seus efeitos. Por este motivo, degarelix reduz rapidamente os níveis da hormona masculina chamada testosterona, que é a responsável pela estimulação do cancro da próstata.
2. O que necessita saber antes de começar a usar FIRMAGON
Não use FIRMAGON
- Se for alérgico ao princípio ativo ou a qualquer um dos outros componentes deste medicamento (incluídos na secção 6).
Advertências e precauções
Consulte o seu médico se sofre:
- Qualquer condição vascular ou problemas de ritmo cardíaco (arritmias) ou se está a ser tratado com medicamentos para corrigir esta alteração. O risco de problemas de ritmo cardíaco pode ser aumentado com a utilização de FIRMAGON.
- Diabetes mellitus. Pode produzir-se um agravamento ou aparecer diabetes. Se tem diabetes, é provável que tenha que medir os níveis de glicose no sangue mais frequentemente.
- Doença hepática. Pode necessitar que lhe supervisionem a função hepática
- Doença renal. Não se investigou o uso de Firmagon em doentes com doença renal grave.
- Osteoporose ou qualquer condição que afete a concentração dos ossos. Níveis reduzidos de testosterona podem causar uma redução no cálcio do osso (adelgaçamento do osso).
- Hipersensibilidade grave. O uso de Firmagon não se investigou em doentes com reações de hipersensibilidade graves.
Crianças e adolescentes
Não administre este medicamento a crianças ou adolescentes.
Uso de FIRMAGONcom outros medicamentos
FIRMAGON pode interferir com alguns medicamentos que se utilizam para tratar problemas do ritmo cardíaco (p. ex: quinidina, procainamida, amiodarona e sotalol) ou com medicamentos que têm efeito sobre o ritmo cardíaco (p. ex: metadona (se usa para o alívio da dor e como parte da desintoxicação da drogadição), moxifloxacino (um antibiótico), antipsicóticos).
Informa ao seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento.
Condução e uso de máquinas
A fadiga e o mareio são efeitos adversos frequentes que podem afetar a capacidade para conduzir e usar máquinas. Estes efeitos adversos podem dever-se ao tratamento ou ser derivados da própria doença.
3. Como USAR FIRMAGON
Em geral, a injeção deste medicamento a realizará um enfermeiro ou um médico.
A dose de início recomendada é de duas injeções consecutivas de 120 mg. Depois, será injetada uma dose mensal de 80 mg. O líquido que se injeta forma um gel a partir do qual degarelix se liberta durante um mês.
FIRMAGON ÚNICAMENTE deve ser injetado sob a pele (injeção subcutânea). FIRMAGON NÃO DEVE ser administrado em sangue (injeção intravenosa). Deve ter-se especial cuidado para evitar a injeção acidental em uma veia. É habitual variar o local da injeção em distintos pontos da parede abdominal.
Se esqueceu de usar FIRMAGON
Se acredita que se esqueceu de administrar a dose mensal de FIRMAGON, pergunte ao seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Possíveis efeitos adversos
Como todos os medicamentos, FIRMAGON pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Uma reação alérgica muito grave a este medicamento é rara. Consulte o seu médico de imediato se desenvolver uma erupção cutânea grave, picazón ou falta de alento ou dificuldade para respirar. Isto poderia ser sintoma de uma reação alérgica grave.
Muito frequentes (podem afetar mais de 1 de cada 10 doentes)
Sofocos, reações adversas no local da injeção e rubor. Os efeitos adversos no local da injeção aparecem mais frequentemente com a dose de início, sendo menos frequentes ao administrar a dose de manutenção.
Frequentes (podem afetar até 1 de cada 10 doentes)
- inchaço, nódulo e dureza no local da injeção
- arrepios, febre ou sintomas parecidos com os da gripe após a injeção
- dificuldade para dormir, cansaço, mareio, dor de cabeça
- aumento de peso, náuseas, diarreia, aumento de certas enzimas hepáticas
- sudorese excessiva (incluindo sudorese noturna), erupção cutânea
- anemia
- dor e desconforto musculoesquelético
- diminuição do tamanho dos testículos, inflamação do peito, impotência.
Pouco frequentes (podem afetar até 1 de cada 100 doentes)
- perda do desejo sexual, dor testicular, dor pélvica, interrupção da ejaculação, irritação genital, dor no peito
- depressão, deterioração mental
- coloração da pele, perda de cabelo, nódulos cutâneos, entorpecimento
- reações alérgicas, urticária, picazón
- diminuição do apetite, prisão de ventre, vómitos, secura da boca, dor e desconforto abdominal, aumento do açúcar no sangue/diabetes mellitus, aumento do colesterol, alteração nos níveis de cálcio no sangue, perda de peso
- pressão sanguínea alta, alterações no ritmo cardíaco, alterações no eletrocardiograma (prolongamento QT), sensação de bombagem anormal do coração, dispneia, edema periférico
- debilidade muscular, espasmo muscular, inchaço/entorpecimento das articulações, osteoporose/osteopenia, dor na articulação
- desejo frequente de urinar, urgência miccional (necessidade imperiosa de urinar), dificuldade ou dor ao urinar, necessidade de urinar à noite, alteração na função renal, incontinência
- visão borrosa
- desconforto na injeção, incluindo diminuição da pressão sanguínea e frequência cardíaca (reação vasovagal)
- desconforto
Raro (pode afetar até 1 de cada 1.000 doentes)
- Neutropenia febril (número muito baixo de células brancas no sangue em combinação com febre), ataque cardíaco, falha cardíaca.
- Dor ou cãibras musculares inexplicáveis, sensibilidade ou debilidade. Os problemas musculares podem ser graves, incluindo a degradação muscular que pode danificar o rim.
Muito raros (podem afetar até 1 de cada 10.000 doentes)
- Infecção no local da injeção, abscesso e necrose
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Anexo V. Mediante a comunicação de efeitos adversos, você pode contribuir para proporcionar mais informações sobre a segurança deste medicamento.
5. Conservação de FIRMAGON
Mantenha fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece nos frascos, seringas e no envase. A data de validade é o último dia do mês que se indica.
Este medicamento não requer condições especiais de conservação.
Após a reconstituição
Este medicamento é estável durante 2 horas a 25ºC.
Devido a um risco de contaminação microbiológica, o medicamento deve ser utilizado imediatamente. Em caso de não utilização imediata, o uso deste medicamento será responsabilidade do utilizador.
Os medicamentos não devem ser jogados fora pelas águas residuais ou lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Desta forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de FIRMAGON
- O princípio ativo é degarelix. Cada frasco contém 120 mg de degarelix (como acetato). Após a reconstituição, 1 ml de solução reconstituída contém 40 mg de degarelix.
- O outro componente do pó é manitol (E 421).
- O dissolvente é água para preparações injetáveis.
Aspecto de FIRMAGON e conteúdo do envase
FIRMAGON é um pó e dissolvente para solução injetável. O pó é de cor branca a branca acinzentada. O dissolvente é uma solução límpida e incolor.
Tamanho do envase de 2 bandejas contendo:
2 frascos de pó que contêm 120 mg de degarelix e 2 seringas pré-carregadas que contêm 3 ml de dissolvente.
2 impulsionadores do êmbolo, 2 adaptadores para o frasco e 2 agulhas para a injeção.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização:
Ferring Pharmaceuticals A/S
Amager Strandvej 405
2770 KastrupDinamarca
Tel. +45 8833 8834
Responsável pela fabricação:
Ferring GmbH
Wittland 11
D-24109 Kiel
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica Ferring N.V. Tel: +32 53 72 92 00 | Lituânia CentralPharma Communication UAB Tel: +370 5 243 0444 |
Bulgária Farmont Ltd. Tel: +359 2 807 5022 | Luxemburgo Ferring N.V. Bélgica Tel: +32 53 72 92 00 |
República Checa Ferring Pharmaceuticals CZ s.r.o. Tel: +420 234 701 333 | Hungria Ferring Magyarország Gyógyszerkereskedelmi Kft. Tel: +36 1 236 3800 |
Dinamarca Ferring Lægemidler A/S Tlf: +45 88 16 88 17 | Malta E.J. Busuttil Ltd. Tel: +356 21447184 |
Alemanha Ferring Arzneimittel GmbH Tel: +49 431 5852 0 | Países Baixos Ferring B.V. Tel: +31 235680300 |
Estônia CentralPharma Communication OÜ Tel: +372 601 5540 | Noruega Ferring Legemidler AS Tlf: +47 22 02 08 80 |
Grécia Ferring Ελλάς MEΠΕ Τηλ: +30 210 68 43 449 | Áustria Ferring Arzneimittel Ges.m.b.H. Tel: +43 1 60 8080 |
Espanha Ferring, S.A.U. Tel: +34 91 387 70 00 | Polônia Ferring Pharmaceuticals Poland Sp. z o.o. Tel: +48 22 246 06 80 |
França Ferring S.A.S. Tél: +33 1 49 08 67 60 | Portugal Ferring Portuguesa – Produtos Farmacêuticos, Sociedade Unipessoal, Lda. Tel: +351 21 940 5190 |
Croácia Clinres farmacija d.o.o. Tel: +385 1 2396 900 | Romênia Ferring Pharmaceuticals Romania SRL Tel: +40 356 113 270 |
Irlanda Ferring Ireland Ltd. Tel: + 353 1 4637355 | Eslovênia SALUS, Veletrgovina, d.o.o. Tel: +386 1 5899 179 |
Islândia Vistor hf. Sími: +354 535 70 00 | Eslováquia Ferring Slovakia s.r.o. Tel: +421 2 54 416 010 |
Itália Ferring S.p.A. Tel: +39 02 640 00 11 | Finlândia Ferring Lääkkeet Oy Puh/Tel: +358 207 401 440 |
Chipre
Τηλ: +357 22583333 | Suécia Ferring Läkemedel AB Tel: +46 40 691 69 00 |
Data da última revisão desteprospecto:
A informação detalhada deste medicamento está disponível na página web da Agência Europeia do Medicamento http://www.ema.europa.eu/.
---------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada unicamente a profissionais do sector sanitário:
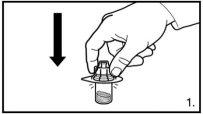
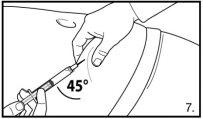
Instruções para a sua correta utilização
NOTA:
- OS FRASCOS NÃO DEVEM SER AGITADOS
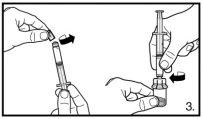
O envase contém dois frascos de pó e duas seringas pré-carregadas com dissolvente que devem ser preparados para injeção subcutânea. Por isso, o procedimento descrito deve ser repetido uma segunda vez.
|
|
| |
|
|
|
Pode ser aceitável a formação de pequenas bolhas de ar de forma circular. O processo de reconstituição normalmente é realizado em poucos minutos, mas em alguns casos pode durar até 15 minutos. |
|
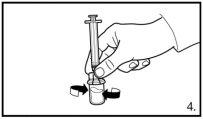
Certifique-se sempre de retirar o volume exatoe ajuste-o em caso de formação de bolhas de ar |
| |
|
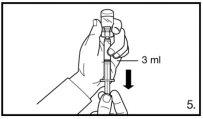
Injete 3 ml de FIRMAGON 120mglentamente, imediatamente após a reconstituição* |
Não injete diretamente dentro de nenhuma veia. Puxe suavemente o êmbolo para verificar se sangue foi aspirado. Se sangue entrar na seringa, não poderá utilizar o produto. Nesse caso, retire e descarte a seringa e a agulha (reconstitua uma nova dose para o paciente). | |
|
- Foi demonstrada a estabilidade química e física do preparado durante 2 horas a 25 ºC. Do ponto de vista microbiológico, a menos que o método de reconstituição implique um risco de contaminação, o produto deve ser utilizado imediatamente. Em caso de não utilização imediata, as condições e o tempo de utilização serão responsabilidade do utilizador.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para fins informativos e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento.
- Alternativas a FIRMAGON 120 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 80 mgSubstância ativa: degarelixFabricante: Ferring Pharmaceuticals A/SRequer receita médicaForma farmacêutica: COMPRIMIDO, 250 mgSubstância ativa: abirateroneFabricante: Accord Healthcare S.L.U.Requer receita médicaForma farmacêutica: COMPRIMIDO, 500 mgSubstância ativa: abirateroneFabricante: Accord Healthcare S.L.U.Requer receita médica
Médicos online para FIRMAGON 120 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL
Avaliação de dosagem, efeitos secundários, interações, contraindicações e renovação de receita para FIRMAGON 120 mg PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL — sujeita a avaliação médica e à regulamentação local.
Perguntas frequentes

Receba atualizações e ofertas exclusivas
Seja o primeiro a conhecer novos serviços, atualizações do marketplace e ofertas exclusivas para subscritores.