XIMLUCI 10 mg/ml SOLUÇÃO INJETÁVEL

Como utilizar XIMLUCI 10 mg/ml SOLUÇÃO INJETÁVEL
Traduzido com IA
Esta informação é fornecida apenas para fins informativos e não substitui a consulta de um médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Mostrar originalConteúdo do folheto informativo
Introdução
Prospecto: informação para o paciente
Ximluci 10 mg/ml solução injetável
ranibizumab
ADULTOS
Este medicamento está sujeito a acompanhamento adicional, o que agilizará a detecção de nova informação sobre a sua segurança. Pode contribuir comunicando os efeitos adversos que possa ter. A parte final da seção 4 inclui informação sobre como comunicar estes efeitos adversos.
Leia todo o prospecto atentamente antes de que lhe administrem este medicamento, porque contém informação importante para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Ximluci e para que se utiliza
- O que necessita saber antes de que lhe administrem Ximluci
- Como se administra Ximluci
- Possíveis efeitos adversos
- Conservação de Ximluci
Conteúdo do envase e informação adicional
1. O que é Ximluci e para que se utiliza
O que é Ximluci
Ximluci é uma solução que se injeta no olho. Ximluci pertence a um grupo de medicamentos denominados agentes anti-angiogénese. Contém o princípio ativo denominado ranibizumab.
Para que se utiliza Ximluci
Ximluci se utiliza em adultos para tratar várias doenças oculares que causam alteração da visão.
Estas doenças são o resultado de uma lesão na retina (camada sensível à luz na parte posterior do olho) provocada por:
- O crescimento de vasos sanguíneos anormais, que perdem líquido. Isto se observa em doenças como a degeneração macular associada à idade (DMAI) e a retinopatia diabética proliferativa (RDP, uma doença provocada pelo diabetes). Também pode ir associado com a neovascularização coroide (NVC) devida à miopia patológica (MP), estrías angioides, corioretinopatia serosa central ou NVC inflamatória.
- Edema macular (inchação do centro da retina). A causa desta inchação pode ser o diabetes (uma doença conhecida como edema macular diabético (EMD)) ou um bloqueio das veias retinianas da retina (uma doença conhecida como oclusão da veia da retina (OVR)).
Como actua Ximluci
Ximluci reconhece e se une de forma específica a uma proteína denominada factor de crescimento endotelial vascular A (VEGF-A) humano presente nos olhos. Em excesso, o VEGF-A causa o crescimento de vasos sanguíneos anormais e inchação no olho que pode ocasionar uma alteração da visão em doenças como DMAI, EMD, RDP, OVR, MP e NVC. Mediante a união ao VEGF-A, Ximluci pode impedir que actue e prevenir dito crescimento e inchação anormais.
Nestas doenças, Ximluci pode ajudar a estabilizar e, em muitos casos, melhorar a sua visão.
2. O que necessita saber antes de que lhe administrem Ximluci
Não lhe devem administrar Ximluci
- Se é alérgico ao ranibizumab ou a algum dos outros componentes deste medicamento (incluídos na seção 6).
- Se tem uma infecção no olho ou à volta do mesmo.
- Se tem dor ou vermelhidão (inflamação intraocular grave) no olho.
Advertências e precauções
Consulte o seu médico antes de que lhe administrem Ximluci
- Ximluci se administra mediante uma injeção no olho. Ocasionalmente, após o tratamento com Ximluci pode aparecer uma infecção na parte interna do olho, dor ou vermelhidão (inflamação), desprendimento ou desgarro de uma das camadas situadas no fundo do olho (desprendimento ou desgarro da retina e desprendimento ou desgarro do epitélio pigmentário da retina), ou enturbiação do cristalino (catarata). É importante identificar e tratar tal infecção ou desprendimento de retina o mais cedo possível. Informe imediatamente o seu médico se nota sinais como dor no olho ou aumento das molestias no olho, se piora a vermelhidão no olho, visão borrosa ou diminuição da visão, um aumento do número de pequenas manchas na visão ou aumento da sensibilidade à luz.
- Em alguns pacientes, após a injeção a pressão no olho pode aumentar durante um curto período de tempo. É possível que o seu médico lhe faça um acompanhamento da pressão ocular após cada injeção.
- Informa o seu médico se teve doenças nos olhos ou recebeu algum tratamento nos olhos anteriormente, ou se sofreu um acidente vascular cerebral ou teve sinais passageiros de acidente vascular cerebral (debilidade ou paralisia de um membro ou face, dificuldade na fala ou na compreensão). Esta informação será tida em consideração para avaliar se Ximluci é o tratamento apropriado para si.
Para consultar informação mais detalhada sobre os efeitos adversos que poderiam ocorrer durante o tratamento com Ximluci, ver seção 4 (“Possíveis efeitos adversos”).
Crianças e adolescentes (menores de 18 anos)
Não se recomenda o uso de Ximluci em crianças e adolescentes, pois não se estabeleceu em estes grupos de idade.
Outros medicamentos e Ximluci
Informa o seu médico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez e lactação
- As mulheres que possam ficar grávidas devem utilizar um método anticonceptivo eficaz durante o tratamento e durante pelo menos os três meses posteriores à última injeção de Ximluci.
- Não há experiência no uso de Ximluci em mulheres grávidas. Ximluci não se deve usar durante a gravidez salvo que o benefício potencial supere o risco potencial para o feto. Se está grávida, acredita que possa estar grávida ou tem intenção de ficar grávida, consulte o seu médico antes do tratamento com Ximluci.
- Não se recomenda o uso de Ximluci durante a lactação, porque se desconhece se Ximluci passa para o leite materno. Consulte o seu médico ou farmacêutico antes do tratamento com Ximluci.
Condução e uso de máquinas
Após o tratamento com Ximluci, pode experimentar visão borrosa temporariamente. Se isto lhe ocorrer, não conduza nem use máquinas até que este sintoma desapareça.
3. Como se administra Ximluci
Ximluci se administra pelo oftalmologista em forma de injeção única no olho sob anestesia local. A dose habitual de uma injeção é 0,05 ml (que contém 0,5 mg de princípio ativo). O intervalo entre duas doses aplicadas no mesmo olho deve ser como mínimo de quatro semanas. Todas as injeções serão administradas por um oftalmologista.
Para prevenir uma infecção, antes da injeção o seu médico lhe lavará o olho cuidadosamente. O seu médico também lhe administrará um anestésico local para reduzir ou prevenir qualquer dor que possa sentir com a injeção.
O tratamento se inicia com uma injeção de Ximluci cada mês. O seu médico controlará a doença do seu olho e dependendo de como responde ao tratamento, decidirá se necessita ou não receber mais tratamento e quando necessita ser tratado.
No final do prospecto, no apartado "Como preparar e administrar Lucentis em adultos" são dadas instruções detalhadas de uso”.
Pacientes de idade avançada (65 anos e mais)
Ximluci pode ser utilizado em pessoas de 65 anos de idade ou mais, e não é necessário um ajuste da dose.
Antes de interromper o tratamento com Ximluci
Se está a considerar interromper o tratamento com Ximluci, acuda à próxima consulta e comente antes com o seu médico. O seu médico aconselhará e decidirá durante quanto tempo deve ser tratado com Ximluci.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora não todas as pessoas os sofram.
Os efeitos adversos associados à administração de Ximluci se devem ou ao próprio medicamento ou ao procedimento de injeção e a maioria afeta o olho.
Efeitos adversos graves:
Frequentes(podem afetar até 1 de cada 10 pacientes)
- desprendimento ou desgarro de uma camada na parte interna do olho (desprendimento ou desgarro da retina), que dá como resultado destellos de luz com partículas flutuantes que progridem a uma perda de visão transitoria ou a uma enturbiação do cristalino (catarata)
Pouco frequentes(podem afetar até 1 de cada 100 pacientes)
- cegueira,
- infecção do globo ocular (endoftalmite) com inflamação da parte interna do olho
Os sintomas que poderia experimentar são:
- dor ou aumento das molestias no olho
- piora da vermelhidão no olho
- visão borrosa ou diminuição da visão
- um aumento do número de pequenas manchas na visão
- aumento da sensibilidade à luz
Informe ao seu médico imediatamente se apresentar algum destes efeitos adversos.
Outros efeitos adversos:
Muito frequentes(podem afetar mais de 1 de cada 10 pacientes)
Os efeitos adversos oculares incluem
- inflamação do olho
- sangramento na parte posterior do olho (hemorragia na retina)
- alterações visuais
- dor no olho
- pequenas partículas ou manchas na visão (partículas flutuantes)
- sangue no olho
- irritação do olho
- sensação de ter algo dentro do olho
- aumento da produção de lágrima
- inflamação ou infecção no bordo das pálpebras
- olho seco
- vermelhidão ou picazão no olho
- aumento da pressão no olho
Os efeitos adversos não oculares incluem
- dor de garganta, congestão nasal, gotejamento nasal
- dor de cabeça
- dor nas articulações
Frequentes(podem afetar até 1 de cada 10 pacientes)
Os efeitos adversos oculares incluem
- diminuição da nitidez da visão
- inchação de uma seção do olho (úvea, córnea)
- inflamação da córnea (parte frontal do olho)
- pequenas marcas na superfície do olho
- visão borrosa
- sangramento no local de injeção
- sangramento no olho
- secreção do olho com picazão, vermelhidão e inchação (conjuntivite)
- sensibilidade à luz
- molestias no olho
- inchação da pálpebra
- dor na pálpebra
Os efeitos adversos não oculares incluem
- infecção das vias urinárias
- contagem de glóbulos vermelhos baixa (com sintomas tais como cansaço, dificuldade ao respirar, tontura, palidez)
- ansiedade
- tosse
- náuseas, reações alérgicas tais como erupção, urticária, picazão e vermelhidão da pele
Pouco frequentes(podem afetar até 1 de cada 100 pacientes)
Os efeitos adversos oculares incluem
- inflamação e sangramento na parte anterior do olho
- acúmulo de pus no olho
- mudanças na parte central da superfície ocular
- dor ou irritação no local de injeção
- sensação anormal no olho
- irritação da pálpebra
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los directamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, pode contribuir para proporcionar mais informação sobre a segurança deste medicamento.
5. Conservação de Ximluci
- Mantenha este medicamento fora da vista e do alcance das crianças.
- Não utilize este medicamento após a data de validade que aparece na caixa e na etiqueta do frasco após CAD. A data de validade é o último dia do mês que se indica.
- Conservar em frigorífico (entre 2°C e 8°C). Não congelar.
- Antes de usar, o frasco sem abrir pode ser conservado a temperatura ambiente (25°C) durante um máximo de 48 horas.
- Conservar o frasco no embalagem exterior para protegê-lo da luz.
- Não utilize nenhum envase que esteja danificado.
6. Conteúdo do envase e informação adicional
Composição de Ximluci
- O princípio ativo é ranibizumab. Cada ml contém 10 mg de ranibizumab. Cada frasco contém 2,3 mg de ranibizumab em 0,23 ml de solução. Isso fornece uma quantidade utilizável para fornecer uma dose única de 0,05 ml, que contém 0,5 mg de ranibizumab.
- Os demais componentes são trealose diidratado; cloridrato de histidina monoidratado; histidina; polissorbato 20; água para injetáveis.
Aspecto do produto e conteúdo do envase
Ximluci é uma solução injetável de transparente a ligeiramente opalescente, de incolora a ligeiramente amarronada contida em um frasco (0,23 ml).
Existem dois tipos de embalagens diferentes:
Embalagem apenas com frasco
Embalagem que contém um frasco de vidro com ranibizumab, com tampa de borracha de bromobutil. O frasco é para uso único.
Embalagem de frasco + agulha com filtro
Embalagem que contém um frasco de vidro com ranibizumab, com tampa de borracha de bromobutil e uma agulha estéril romba com filtro de 5 µm (18G x 1½″, 1,2 mm x 40 mm) para extrair o conteúdo do frasco.
Todos os componentes são para uso único.
Título da autorização de comercialização e responsável pela fabricação
STADA Arzneimittel AG
Stadastrasse 2-18
61118 Bad Vilbel
Alemanha
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Bélgica EG (Eurogenerics) NV Tel: + 32 4797878 | Lituânia UAB „STADA Baltics“ Tel: + 370 52603926 |
STADA Bulgária EOOD Tel: + 359 29624626 | Luxemburgo EG (Eurogenerics) NV Tel: + 32 4797878 |
República Tcheca STADA PHARMA CZ s.r.o. Tel: + 420 257888111 | Hungria STADA Hungria Kft Tel: + 36 18009747 |
Dinamarca STADA Nordic ApS Tlf: + 45 44859999 | Malta Pharma MT Ltd Tel: + 356 21337008 |
Alemanha STADAPHARM GmbH Tel: + 49 61016030 | Países Baixos Centrafarm B.V. Tel: + 31 765081000 |
Estônia UAB „STADA Baltics“ Tel: + 370 52603926 | Noruega STADA Nordic ApS Tlf: + 45 44859999 |
Grécia STADA Arzneimittel AG Tel: +30 2106664667 | Áustria STADA Arzneimittel GmbH Tel: + 43 136785850 |
Espanha Laboratório STADA, S.L. Tel: + 34 934738889 | Polônia STADA Polônia Sp. z.o o. Tel: + 48 227377920 |
França EG LABO - Laboratoires EuroGenerics Tel: + 33 146948686 | Portugal Stada, Lda. Tel: + 351 211209870 |
Croácia STADA d.o.o. Tel: + 385 13764111 | Romênia STADA M&D SRL Tel: + 40 213160640 |
Irlanda Clonmel Healthcare Ltd. Tel: + 353 526177777 | Eslovênia Stada d.o.o. Tel: + 386 15896710 |
Islândia STADA Arzneimittel AG Tel: + 49 61016030 | República Eslovaca STADA PHARMA Eslováquia, s.r.o. Tel: + 421 252621933 |
Itália EG SpA Tel: + 39 028310371 | Finlândia STADA Nordic ApS, Filial na Finlândia Tel: + 358 207416888 |
Chipre STADA Arzneimittel AG Tel: +30 2106664667 | Suécia STADA Nordic ApS Tel: + 45 44859999 |
Letônia UAB „STADA Baltics“ Tel: + 370 52603926 | Reino Unido (Irlanda do Norte) STADA Arzneimittel AG Tel: +49 61016030 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: http://www.ema.europa.eu
ESTA INFORMAÇÃO É DESTINADA APENAS A PROFISSIONAIS DE SAÚDE:
Ver também a seção 3 “Como administrar Ximluci”.
Como preparar e administrar Ximluci em adultos
Frasco para uso único. Apenas para via intravítrea.
Ximluci deve ser administrado por um oftalmologista que tenha experiência na administração de injeções intravítreas.
Na DMAE exsudativa, na NVC, na RDP e na alteração visual devida a EMD ou a edema macular secundário a OVR, a dose recomendada de Ximluci é 0,5 mg administrada em forma de injeção intravítrea única. Isso corresponde a um volume de injeção de 0,05 ml. O intervalo entre duas doses injetadas no mesmo olho deve ser de pelo menos quatro semanas.
O tratamento é iniciado com uma injeção por mês até alcançar a acuidade visual máxima e/ou não haja sinais de atividade da doença, ou seja, nenhum cambio na acuidade visual nem em outros sinais e sintomas da doença sob tratamento contínuo. Em pacientes com DMAE exsudativa, EMD, RDP e OVR, inicialmente podem ser necessárias três ou mais injeções consecutivas administradas mensalmente.
A partir desse momento, os intervalos de monitorização e tratamento devem ser determinados de acordo com o critério médico e com base na atividade da doença, avaliada mediante a acuidade visual e/ou parâmetros anatômicos.
Deve-se interromper o tratamento com Ximluci se, sob critério do médico, os parâmetros visuais e anatômicos indicam que o paciente não está se beneficiando do tratamento contínuo.
A monitorização para determinar a atividade da doença pode incluir exame clínico, controle funcional ou técnicas de imagem (p. ex. tomografia de coerência óptica ou angiografia com fluoresceína).
Se os pacientes estiverem sendo tratados de acordo com um regime de tratar e estender, uma vez que a acuidade visual máxima tenha sido alcançada e/ou não haja sinais de atividade da doença, os intervalos de tratamento podem ser espaçados gradualmente até que voltem a aparecer sinais de atividade da doença ou alteração visual. No caso da DMAE exsudativa, o intervalo de tratamento não deve ser espaçado em mais de duas semanas cada vez, e no caso do EMD, pode ser espaçado até um mês cada vez. Para a RDP e a OVR, os intervalos de tratamento também podem ser espaçados gradualmente, no entanto, os dados disponíveis não são suficientes para determinar a duração desses intervalos. Se a atividade da doença voltar a aparecer, o intervalo de tratamento deve ser encurtado de forma consecutiva.
O tratamento da alteração visual devida a NVC deve ser determinado para cada paciente de forma individualizada com base na atividade da doença. Alguns pacientes podem precisar apenas de uma injeção durante os primeiros 12 meses; outros podem precisar de tratamento com mais frequência, incluindo uma injeção mensal. No caso de NVC secundária à miopia patológica (MP), muitos pacientes podem precisar apenas de uma ou duas injeções durante o primeiro ano.
Ximluci e fotocoagulação com laser em EMD e edema macular secundário a oclusão da ramo venosa retiniana (ORVR)
Existe alguma experiência com Ximluci administrado concomitantemente com fotocoagulação com laser. Quando administrados no mesmo dia, Ximluci deve ser administrado pelo menos 30 minutos após a fotocoagulação com laser. Ximluci pode ser administrado em pacientes que receberam fotocoagulação com laser previamente.
Ximluci e a terapia fotodinâmica com verteporfina na NVC secundária à MP
Não há experiência na administração concomitante de Ximluci e verteporfina.
Antes da administração de Ximluci, deve-se verificar visualmente a ausência de partículas e decoloração.
O procedimento de injeção deve ser realizado sob condições assépticas, que incluem o lavado quirúrgico das mãos, o uso de luvas estéreis, um campo estéril, um blefarostato estéril para as pálpebras (ou equivalente) e a disponibilidade de uma paracentese estéril (se necessário). Antes de realizar o procedimento de injeção intravítrea, deve-se avaliar detalhadamente a história clínica do paciente em relação a reações de hipersensibilidade. Antes da injeção, deve-se administrar uma anestesia adequada e um microbicida tópico de amplo espectro para desinfetar a pele da zona periocular, pálpebra e superfície ocular, de acordo com a prática local.
Embalagem apenas com frasco
O frasco é para uso único. Após a injeção, deve-se descartar qualquer sobra de produto não utilizado. Não se deve utilizar nenhum frasco que mostre sinais de deterioração ou manipulação. A esterilidade só pode ser garantida se o selo da embalagem for mantido intacto.
Para a preparação e a injeção intravítrea, são necessários os seguintes produtos sanitários (para uso único):
- uma agulha estéril com filtro de 5 µm (18G x 1½″, 1,2 mm x 40 mm)
- uma seringa estéril de 1 ml (que inclua uma marca em 0,05 ml)
- uma agulha para injeção (30G x ½″, 0,3 mm x 13 mm).
Esses produtos sanitários não estão incluídos na embalagem de Ximluci.
Embalagem de frasco + agulha com filtro
Todos os componentes são estéreis e para uso único. Não se deve utilizar nenhum componente cuja embalagem mostre sinais de deterioração ou manipulação. A esterilidade só pode ser garantida se o selo da embalagem dos componentes for mantido intacto. A reutilização pode dar origem a uma infecção ou outra doença/lesão.
Para a preparação e a injeção intravítrea, são necessários os seguintes produtos sanitários (para uso único):
- uma agulha estéril com filtro de 5 µm (18G x 1½″, 1,2 mm x 40 mm, fornecida)
- uma seringa estéril de 1 ml (que inclua uma marca em 0,05 ml, não incluída na embalagem de Ximluci)
- uma agulha para injeção (30G x ½″, 0,3 mm x 13 mm; não incluída na embalagem de Ximluci)
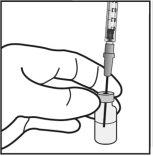
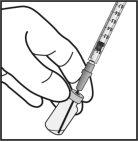
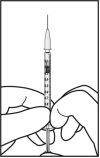
Para a preparação de Ximluci para administração intravítrea em pacientes adultos, siga as seguintes instruções:
|
|
|
|
Nota: Segure a agulha para injeção pelo cone enquanto retira a cápsula de fechamento. |
|
Nota: Não seque a agulha para injeção. Não puxe o êmbolo para trás. |
|
A agulha para injeção deve ser introduzida 3,5-4,0 mm por trás do limbo na cavidade vítrea, evitando o meridiano horizontal e em direção ao centro do globo. Em seguida, deve-se liberar o volume de injeção de 0,05 ml; as injeções seguintes devem ser aplicadas cada vez em um ponto escleral distinto.
Após a injeção, não cubra a agulha com a cápsula de fechamento nem separe-a da seringa. Elimine a seringa usada junto com a agulha em um contenedor para objetos pontiagudos ou elimine de acordo com a regulamentação local.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para fins informativos e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento.
- Alternativas a XIMLUCI 10 mg/ml SOLUÇÃO INJETÁVELForma farmacêutica: INJETÁVEL, 10 mg/mLSubstância ativa: ranibizumabFabricante: Samsung Bioepis Nl B.V.Requer receita médicaForma farmacêutica: INJETÁVEL, 10 mg/mLSubstância ativa: ranibizumabFabricante: Novartis Europharm LimitedRequer receita médicaForma farmacêutica: INJETÁVEL, 10 mg/mLSubstância ativa: ranibizumabFabricante: Novartis Europharm LimitedRequer receita médica
Médicos online para XIMLUCI 10 mg/ml SOLUÇÃO INJETÁVEL
Avaliação de dosagem, efeitos secundários, interações, contraindicações e renovação de receita para XIMLUCI 10 mg/ml SOLUÇÃO INJETÁVEL — sujeita a avaliação médica e à regulamentação local.
Perguntas frequentes

Receba atualizações e ofertas exclusivas
Seja o primeiro a conhecer novos serviços, atualizações do marketplace e ofertas exclusivas para subscritores.