BEOVU 120 mg/mL Solução injetável em seringa pré-carregada

Como utilizar BEOVU 120 mg/mL Solução injetável em seringa pré-carregada
Traduzido com IA
Esta informação é fornecida apenas para fins informativos e não substitui a consulta de um médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
Mostrar originalConteúdo do folheto informativo
Introdução
Prospecto: informação para o paciente
Beovu 120mg/ml solução injetável em seringa pré-carregada
brolucizumab
Leia todo o prospecto detenidamente antesdeque lhe administremeste medicamento, porque contém informações importantes para si.
- Conservar este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico.
- Se experimentar efeitos adversos, consulte o seu médico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver secção 4.
Conteúdo do prospecto
- O que é Beovu e para que é utilizado
- O que necessita saber antes de que lhe administrem Beovu
- Como é administrado Beovu
- Possíveis efeitos adversos
- Conservação de Beovu
- Conteúdo do envase e informação adicional
1. O que é Beovu e para que é utilizado
O que é Beovu
Beovu contém a substância ativa brolucizumab, que pertence a um grupo de medicamentos chamados agentes anti-angiogénese. Beovu é injetado no olho pelo médico para tratar afecções do olho que podem afetar a sua visão.

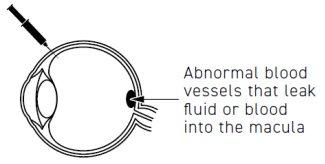
Para que é utilizado Beovu
Beovu é utilizado em adultos para tratar afecções do olho que ocorrem quando se formam e crescem vasos sanguíneos anormais sob a mácula. A mácula, que está na parte posterior do olho, é responsável por uma visão clara. Os vasos sanguíneos anormais podem permitir a fuga de líquido ou sangue para o interior do olho e afetar o funcionamento da mácula, provocando doenças que podem causar uma diminuição da visão, tais como:
- degeneração macular associada à idade exsudativa (DMAE exsudativa)
- edema macular diabético (EMD)
Como actua Beovu
Beovu pode retardar a progressão da doença e com isso manter ou mesmo melhorar a sua visão.
2. O que necessita saber antes de que lhe administrem Beovu
Não lhe devem administrar Beovu:
- se é alérgico ao brolucizumab ou a algum dos outros componentes deste medicamento (incluídos na secção 6).
- se tem uma infecção ativa ou suspeita que possa ter uma infecção no olho ou à sua volta.
- se tem dor ou vermelhidão no olho (inflamação do olho).
Se se encontra em alguma dessas situações, informe o seu médico. Não se lhe deve administrar Beovu.
Advertências e precauções
Consulte o seu médico antes de que lhe administrem Beovu se se encontra em alguma dessas situações:
- se tem glaucoma (uma afecção do olho geralmente causada por pressão elevada dentro do olho).
- se tem antecedentes de ver destelos de luz ou partículas flutuantes (manchas escuras flutuantes) e se de repente aumenta o tamanho e número de partículas flutuantes.
- se foi operado do olho nas últimas 4 semanas ou tem programada uma cirurgia no olho nas próximas quatro semanas.
- se teve alguma vez doenças nos olhos ou recebeu algum tratamento nos olhos.
- se tem antecedentes no último ano de perda repentina de visão devido ao bloqueio dos vasos sanguíneos do fundo do olho (oclusão vascular retiniana) ou inflamação dos vasos sanguíneos do fundo do olho (vasculite retiniana).
Informe imediatamente o seu médicose:
- apresenta vermelhidão no olho, dor no olho, aumento das molestias, piora da vermelhidão no olho, visão borrosa ou diminuída, um aumento do número de pequenas partículas na visão, aumento da sensibilidade à luz.
- desenvolve uma perda repentina de visão, que poderia ser um sinal de oclusão vascular retiniana.
Qualquer um desses sintomas pode fazer com que o seu médico interrompa o tratamento com Beovu.
Além disso, é importante que saiba que:
- a segurança e eficácia de Beovu quando administrado em ambos os olhos ao mesmo tempo não foram estudadas e, se for utilizado desta forma, pode dar origem a um maior risco de que se produzam efeitos adversos.
- as injeções com Beovu podem produzir um aumento da pressão dentro do olho (pressão intraocular) em alguns pacientes nos 30 minutos seguintes à injeção. O seu médico fará um acompanhamento após cada injeção.
- o seu médico verificará se tem outros fatores de risco que possam aumentar a possibilidade de que se produza um desgarro ou um desprendimento de uma das camadas posteriores do olho (desgarro ou desprendimento de retina, e desgarro ou desprendimento do epitélio pigmentário da retina) e, nesse caso, Beovu será administrado com precaução.
O uso sistémico de inibidores do VEGF, substâncias semelhantes às que contém Beovu, está possivelmente relacionado com o risco de bloqueio dos vasos sanguíneos por coágulos de sangue (acontecimentos tromboembólicos arteriais), que podem dar origem a um infarto de miocárdio ou um acidente cerebrovascular. Após a injeção de Beovu no olho, existe um risco teórico de que se possam produzir estes acontecimentos.
Crianças e adolescentes
Beovu não é utilizado em crianças nem adolescentes menores de 18 anos de idade.
Outros medicamentos e Beovu
Informar o seu médico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Gravidez e amamentação
Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de que lhe administrem este medicamento.
Não se recomenda a amamentação durante o tratamento com Beovu nem até pelo menos um mês após o fim do tratamento com Beovu, porque se desconhece se Beovu passa para o leite materno.
As mulheres em idade fértil devem utilizar métodos anticonceptivos eficazes durante o tratamento e até pelo menos um mês após o fim do tratamento com Beovu. Se durante o tratamento engravidar ou acreditar que está grávida, informe imediatamente o seu médico. Não se deve usar Beovu durante a gravidez, a menos que o benefício potencial supere o risco potencial para o feto.
Condução e uso de máquinas
Após a injeção com Beovu pode ter alguns problemas visuais transitórios (por exemplo, visão borrosa). Não conduza nem use máquinas enquanto durarem estes problemas.
Beovu contém sódio
Este medicamento contém menos de 1 mmol de sódio (23 mg) por dose; isto é, é essencialmente “isento de sódio”.
Beovu contém polissorbatos
Este medicamento contém 0,01 mg de polissorbato 80 por dose (0,05 ml). Os polissorbatos podem causar reações alérgicas. Informe o seu médico se tem alguma alergia conhecida.
3. Como é administrado Beovu
Quantidade e frequência em que é administrado Beovu
A dose recomendada é 6 mg de brolucizumab.
DMAE exsudativa
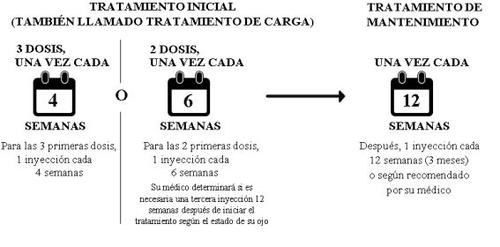
Tratamento inicial (também chamado tratamento de carga)
- O tratamento consistirá em uma injeção por mês durante os 3 primeiros meses.
- Alternativamente, poderia ser tratado com uma injeção a cada 6 semanas para as duas primeiras doses. O seu médico determinará se é necessária uma terceira injeção 12 semanas após o início do tratamento, de acordo com o estado do(s) seu(s) olho(s).
Tratamento de manutenção
- Posteriormente pode receber uma injeção a cada 3 meses. O seu médico determinará o intervalo de tratamento de acordo com o estado do olho; alguns pacientes podem necessitar de tratamento a cada 2 meses. Dependendo do estado do olho, o seu médico poderia estender ou reduzir o intervalo de tratamento por não mais de 1 mês de cada vez. Existem dados limitados para intervalos de tratamento superiores a 5 meses. O intervalo de tratamento entre duas doses de Beovu não deve ser inferior a cada 2 meses.
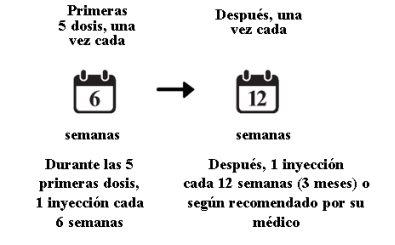
EMD
- O tratamento consistirá em uma injeção a cada 6 semanas durante as cinco primeiras injeções.
- Posteriormente pode receber uma injeção a cada 3 meses. O seu médico determinará o intervalo de tratamento de acordo com o estado do olho. Alguns pacientes podem necessitar de tratamento a cada 2 meses. Alguns pacientes podem receber tratamento a cada 4 meses.
Forma de administração
Beovu é administrado sob a forma de injeção no interior do olho (uso intravítreo) por um oftalmologista.
Antes da injeção, o seu médico limpará cuidadosamente o seu olho para prevenir uma infecção. O seu médico também lhe administrará um colírio (anestésico local) para reduzir ou prevenir a dor derivada da injeção.
Duração do tratamento com Beovu
Beovu é utilizado para tratar doenças crónicas do olho que requerem tratamento a longo prazo, que possivelmente dure meses ou anos. Nas revisões periódicas, o seu médico verificará se o tratamento está a funcionar. O seu médico também pode examinar os seus olhos entre injeções. Se tiver dúvidas sobre a duração do tratamento com Beovu, fale com o seu médico.
Antes de interromper o tratamento com Beovu
Consulte o seu médico antes de interromper o tratamento. Suspender o tratamento pode aumentar o risco de que a visão diminua e piore.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram. Os efeitos adversos com a injeção de Beovu devem-se ou ao próprio medicamento ou derivados do procedimento de injeção e a maioria deles afeta o olho.
Alguns efeitos adversos podem ser graves
Obtenha ajuda médica imediatamente se tiver algum dos seguintes sintomas, que são sinais de reações alérgicas, inflamações ou infecções:
- uma diminuição ou mudança repentina na visão
- dor, aumento das molestias, piora da vermelhidão no olho
Se tiver algum efeito adverso grave, consulte imediatamente o seu médico.
Outros possíveis efeitos adversos
A seguir é incluída uma lista de outros efeitos adversos que podem ocorrer após o tratamento com Beovu.
A maioria dos efeitos adversos é leve ou moderada e geralmente desaparece em uma semana após cada injeção.
Se estes efeitos adversos se tornarem graves, informe o seu médico.
Frequentes:podem afetar até 1 de cada 10pessoas
- inflamação da camada intermédia da parede do olho (uveíte)
- desprendimento da substância semelhante a um gel que se encontra no interior do olho (desprendimento vítreo)
- desgarro da retina (zona da parte posterior do olho que detecta a luz) ou de uma das suas camadas (desgarro do epitélio pigmentário da retina)
- redução da definição na visão (diminuição da acuidade visual)
- sangramento na retina (hemorragia retiniana)
- inflamação do íris, a parte colorida do olho (irite)
- inflamação do íris ou de outras partes do olho (iridociclite)
- perda repentina de visão devido ao bloqueio dos vasos sanguíneos do fundo do olho (oclusão vascular retiniana)
- sangramento no olho (hemorragia vítrea)
- enturbiação do cristalino do olho (catarata)
- sangue no olho devido ao sangramento de pequenos vasos sanguíneos nas camadas externas do olho (hemorragia conjuntival)
- manchas em movimento na visão (partículas flutuantes)
- dor no olho
- aumento da pressão dentro do olho (aumento da pressão intraocular)
- vermelhidão da parte branca do olho (conjuntivite)
- visão borrosa ou pouco clara
- córnea rasgada, dano à camada transparente do globo ocular que cobre o íris (abrasão corneal)
- dano à camada transparente do globo ocular que cobre o íris (queratite punctata)
- reações alérgicas (hipersensibilidade)
Pouco frequentes:podem afetar até 1 de cada 100pessoas
- inflamação grave dentro do olho (endoftalmite)
- cegueira
- perda repentina de visão devido ao bloqueio de uma artéria no olho (oclusão arterial retiniana)
- desprendimento da retina
- vermelhidão do olho (hiperemia conjuntival)
- aumento da produção de lágrimas (lagrimeo aumentado)
- sensação anormal no olho
- desprendimento de uma das camadas da retina (desprendimento do epitélio pigmentário da retina)
- inflamação da substância semelhante a um gel que se encontra no interior do olho (vitrite)
- inflamação da parte frontal do olho (inflamação ou destelos da câmara anterior)
- inchação ocular da córnea, a camada superficial do globo ocular (edema corneal)
- inflamação dos vasos sanguíneos do fundo do olho (vasculite retiniana)
- inflamação do revestimento exterior branco do olho (esclerite)
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do sistema nacional de notificação incluído no Apêndice V. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Beovu
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa e na etiqueta após CAD/EXP. A data de validade é o último dia do mês que se indica.
Conservar em frigorífico (entre 2 ºC e 8 ºC).
Não congelar.
Conservar a seringa pré-carregada no seu blister selado e no embalagem exterior para protegê-la da luz.
Antes de usar, o blister não aberto com a seringa pré-carregada pode ser conservado a temperatura ambiente (por debaixo de 25 ºC) durante um máximo de 24 horas.
6. Conteúdo do envase e informação adicional
Composição deBeovu
- O princípio ativo é brolucizumab. Um ml de solução injetável contém 120 mg de brolucizumab. Uma seringa pré-carregada contém 19,8 mg de brolucizumab em 0,165 ml de solução. Isso fornece uma quantidade utilizável que fornece uma dose única de 0,05 ml de solução, que contém 6 mg de brolucizumab.
- Os outros componentes são: citrato de sódio, sacarose, polissorbato 80, hidróxido de sódio (para ajustar o pH), água para preparações injetáveis (ver seção 2).
Aspecto do produto e conteúdo do envase
Beovu 120 mg/ml solução injetável em seringa pré-carregada (injetável) é uma solução aquosa transparente a ligeiramente opalescente, de incolora a amarelo pálido.
O tamanho do envase é de 1 seringa pré-carregada para um único uso.
Titular da autorização de comercialização
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublín 4
Irlanda
Responsável pela fabricação
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Bélgica
Novartis Pharma GmbH
Roonstraße 25
90429 Nuremberg
Alemanha
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Alemanha
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização
Bélgica Novartis Pharma N.V. Tel: +32 2 246 16 11 | Lituânia SIA Novartis Baltics Lietuvos filialas Tel: +370 5 269 16 50 |
Novartis Bulgaria EOOD Tel: +359 2 489 98 28 | Luxemburgo Novartis Pharma N.V. Tel: +32 2 246 16 11 |
República Checa Novartis s.r.o. Tel: +420 225 775 111 | Hungria Novartis Hungária Kft. Tel: +36 1 457 65 00 |
Dinamarca Novartis Healthcare A/S Tel: +45 39 16 84 00 | Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
Alemanha Novartis Pharma GmbH Tel: +49 911 273 0 | Países Baixos Novartis Pharma B.V. Tel: +31 88 04 52 111 |
Estônia SIA Novartis Baltics Eesti filiaal Tel: +372 66 30 810 | Noruega Novartis Norge AS Tel: +47 23 05 20 00 |
Grécia Novartis (Hellas) A.E.B.E. Tel: +30 210 281 17 12 | Áustria Novartis Pharma GmbH Tel: +43 1 86 6570 |
Espanha Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 | Polônia Novartis Poland Sp. z o.o. Tel: +48 22 375 4888 |
França Novartis Pharma S.A.S. Tel: +33 1 55 47 66 00 | Portugal Novartis Farma - Produtos Farmacêuticos, S.A. Tel: +351 21 000 8600 |
Croácia Novartis Hrvatska d.o.o. Tel: +385 1 6274 220 | Romênia Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
Irlanda Novartis Ireland Limited Tel: +353 1 260 12 55 | Eslovênia Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
Islândia Vistor hf. Tel: +354 535 7000 | República Eslovaca Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
Itália Novartis Farma S.p.A. Tel: +39 02 96 54 1 | Finlândia Novartis Finland Oy Tel: +358 (0)10 6133 200 |
Chipre Novartis Pharma Services Inc. Tel: +357 22 690 690 | Suécia Novartis Sverige AB Tel: +46 8 732 32 00 |
Letônia SIA Novartis Baltics Tel: +371 67 887 070 |
Data da última revisão deste prospecto:
Outras fontes de informação
A informação detalhada sobre este medicamento está disponível no site da Agência Europeia de Medicamentos: https://www.ema.europa.eu/
Esta informação é destinada apenas a profissionais de saúde:
Instruções de uso da seringa pré-carregada
Conservação e inspeção
| Conservar Beovu na geladeira (entre 2 °C e 8 °C). Não congelar. Conservar a seringa pré-carregada em seu blister selado e no embalagem exterior para protegê-la da luz. |
| Antes de usar, o blister não aberto que contém a seringa pré-carregada de Beovu pode ser conservado à temperatura ambiente (abaixo de 25 °C) por um máximo de 24 horas. Certifique-se de que o envase contém uma seringa pré-carregada estéril em um blister selado. Depois de abrir o blister, proceda sob condições assépticas. |
| Beovu é uma solução aquosa transparente a ligeiramente opalescente, de incolora a amarelo pálido. |
| Deve-se inspecionar visualmente a solução uma vez retirada da geladeira e antes de sua administração. Se forem vistas partículas ou turbidez, não se deve usar a seringa pré-carregada e se devem seguir os procedimentos de substituição apropriados. A seringa pré-carregada é estéril e para um único uso. Não a use se o envase ou a seringa pré-carregada estiverem deteriorados ou vencidos. |
Como preparar e administrar Beovu
A seringa pré-carregada contém mais quantidade do que a dose recomendada de 6 mg. O volume extraível da seringa pré-carregada (0,165 ml) não será administrado em sua totalidade. O excesso de volume deve ser expulsado antes da injeção. Se for injetado todo o volume da seringa pré-carregada, pode dar origem a uma sobredose.
O procedimento de injeção intravítrea deve ser realizado sob condições assépticas, que incluem o lavagem quirúrgica das mãos, o uso de luvas estéreis, um campo estéril e um blefarostato estéril para as pálpebras (ou equivalente). Se necessário, deve estar disponível um equipamento de paracentese estéril.
Antes da injeção, deve-se administrar uma anestesia adequada e um microbicida tópico de amplo espectro para desinfetar a pele da zona periocular, pálpebra e superfície ocular.
Para a injeção intravítrea, deve-se usar uma agulha para injeção estéril 30G x ½″. A agulha para injeção não está incluída no envase de Beovu.
Certifique-se de que a injeção seja administrada imediatamente após a preparação da dose (passo 5).
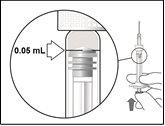
Nota: A dose a ser administrada deve ser ajustada para 0,05 ml.
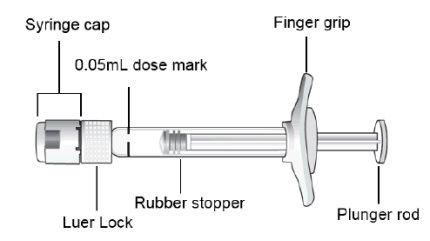
Procedimento de injeção
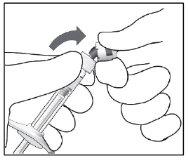
1. | Retirar a cobertura do blister da seringa e, usando uma técnica asséptica, retirar a seringa cuidadosamente. |
2.
| Puxar e remover a cápsula de fechamento da seringa (não a gire nem a torça). |
3. | Usando uma técnica asséptica, encaixar firmemente a agulha para injeção 30G x ½″ na seringa. |
4.
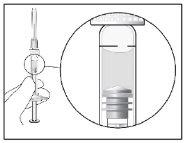
| Mantenha a seringa com a agulha apontando para cima e verifique se não há bolhas de ar em seu interior. Se houver, bata suavemente a seringa com o dedo até que elas subam para a parte superior. Remova a cápsula de fechamento da agulha cuidadosamente, puxando diretamente para fora. |
5.
| Mantenha a seringa à altura dos olhos e pressione cuidadosamente o êmbolo até que a borda inferior da cúpula que forma a extremidade da tampa de borracha fique alinhada com a marca de dose de 0,05 ml. Isso expulsará o ar e o excesso de solução e ajustará a dose para 0,05 ml. A seringa está pronta para a injeção. |
6. | Injetar lentamente até que a tampa de borracha chegue à parte inferior da seringa, com o objetivo de administrar o volume de 0,05 ml. Confirme a administração da dose completa verificando se a tampa de borracha chegou ao final da seringa. |
Nota: A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a regulamentação local.
Perguntas e respostas frequentes
P: O que acontece se não consigo eliminar todas as bolhas de ar dentro do líquido?
R: É importante que o líquido esteja livre de ar. No entanto, as pequenas bolhas de ar que se aderem à tampa geralmente não se desprendem da tampa durante a injeção e, portanto, não afetam o volume da dose.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para fins informativos e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento.
- Alternativas a BEOVU 120 mg/mL Solução injetável em seringa pré-carregadaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 40 mg/mlSubstância ativa: afliberceptFabricante: Sandoz GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 10 mg/mLSubstância ativa: ranibizumabFabricante: Samsung Bioepis Nl B.V.Requer receita médica
Médicos online para BEOVU 120 mg/mL Solução injetável em seringa pré-carregada
Avaliação de dosagem, efeitos secundários, interações, contraindicações e renovação de receita para BEOVU 120 mg/mL Solução injetável em seringa pré-carregada — sujeita a avaliação médica e à regulamentação local.
Perguntas frequentes

Receba atualizações e ofertas exclusivas
Seja o primeiro a conhecer novos serviços, atualizações do marketplace e ofertas exclusivas para subscritores.